TANGGAL: 19 NOVEMBER 2014
WAKTU: 10:00-12:30
DOSEN: HERMAWAN SEFTIONO
ASAM AMINO DAN PROTEIN
KELOMPOK 3:
EMILIA RATIH SAPUTRI – 13106003
MAYA ADRIYANTI – 13106006
RANI NURAENI – 13106012
SHERLY PRISCILA – 13106008
ILMU DAN TEKNOLOGI PANGAN
FAKULTAS BIOINDUSTRI
UNIVERSITAS TRILOGI
2014
BAB I
PENDAHULUAN
1. Latar Belakang
Asam amino adalah senyawa organic yang merupakan satuan penyusun protein yang mempunyai gugus amino dan karboksilat. Oleh karena itu asam amino mempunyai sifat-sifat asam maupun basa. Asam amino bersifat tidak seperti senyawa-senyawa organic, tetapi mirip dengan garam-garam anorganik.
Pada umumnya asam amino larut dalam air, tetapi hanya larut sebagian didalam pelarut organic. Titik leleh asam-asam amino sangat tinggi untuk senyawa-senyawa organic dengan massa molekul relative rendah dan kebanyakan lebih besar dari 200oC. Hal ini dapat dijelaskan karena asam amino didalam larutan netral akan membentuk zwitter ion (ion yang bermuatan ganda). Titik leleh yang tinggi dapat pula dijelaskan dalam hubungannya dengan energy yang dibutuhkan untuk memecahkan ikatan-ikatan ionik dalam kisi kristalnya.
Beberapa asam amino mengandung gugus terionisasi pada samping R, hal ini mempengaruhi karakteristik apakah asam amino tersebut bebas di dalam larutan atau bergabung dengan asam amino yang lain. Pada kenyataannya, sifat muatan dari protein ditentukan banyaknya gugus yang terionisasi pada rantai samping asam amino. Dalam protein, asam amino satu dengan asam amino yang lain bergabung melalui ikatan (-CO—NH-). Ikatan peptidadibentuk dengan kondensasi gugus –COOH dari asam amino yang satu dengan gugus –NH2 dari asam amino yang lain.
Protein merupakan polimer dari asam amino dimana struktur dari protein ada 4 macam yaitu: struktur primer; sekunder; tersier; dan kuartener. Struktur primer protein ditentukan oleh ikatan kovalen antara residu asam amino yang beurutan membentuk ikatan peptide. Struktur sekunder terjadi karena ikatan hydrogen anatara atom O dari gugus karbonil dengan atom H dari gugus amina dalam suatu rantai polipeptida membentuk konfirmasi spiral yang disebut struktur helix. Bila ikatan hydrogen tersebut terjadi antara dua rantai polipeptida maka membentuk rantai parallel dengan bentuk berkelok-kelok yang disebut konfirmasi β . Struktur tersier terbentuk karena terjadinya pelipatan (folding) rantai α helix, konfirmasi β maupun gulungan suatu polipeptida membentuk protein globular. Sebagian besar protein berbentuk globular yang mempunyai berat molekul ≥50.000 merupakan suatu oligomer yang terjadi dari beberapa rantai polipeptidayang terpisah. Rantai polipeptida ini mengadakan interaksi, membentuk struktur kuartener dari protein oligomer. Protein merupakan bahan pembentuk makhluk hidup, katalisator organic atau biasa disebut enzim, dan bagian penting dari nucleoprotein.
2. Tujuan
Mempelajari sifat-sifat reaksi asam amino
Melakukan identifikasikan asam amino dan protein
Menentukan senyawa-senyawa asam amino secara kualitatif
BAB II
METODE
1. Waktu dan Tempat
Hari/Tanggal : Rabu, 19 November 2014
Tempat : Laboratorium Biokimia Lt.4 Universitas Trilogi
2. Alat dan Bahan
Alat :
Tabung reaksi, rak tabung, pipet tetes, pipet ukur, gelas plastic, waterbath (penangas air)
Bahan :
Asam amino (glisin, tirosin, asam glutamate, prolin), aquadest, HCl 0,1 N, NaOH 1 M, etanol, kloroform, ninhidrin, CuSO4, albumin, keju, tahu.
3. Prosedur Praktikum
– Kelarutan Asam Amino dan Protein
– Dimasukkan masing-masing 1 gr sampel asam amino kedalam tabung reaksi
– Dilarutkan dalam pelarut: air, HCl 0,1 N, NaOH 1 M, etanol, kloroform
– Dikocok
– Diamati kelarutannya
– Reaksi Ninhidrin
– Dimasukkan 1 ml sampel asam amino kedalam tabung reaksi
– Ditambahkan 5 tetes Ninhidrin
– Dipanaskan dalam waterbath selama 2 menit
– Diamati perubahan
– Denaturasi Protein oleh Panas dan pH
– Dimasukkan masing-masing 5 ml sampel asam amino kedalam 3 tabung reaksi
– Tabung 1 : ditambahkan 0,5 HCl 0,1 N
– Tabung 2 : ditambahkan 0,5 NaOH 0,1 M
– Tabung 3 : ditambahkan 0,5 aquadest
– Dipanaskan dalam waterbath selama 10 menit
– Diamati perubahan
– Uji Biuret
– Dimasukkan 1 ml asam amino kedalam tabung reaksi
– Ditambahkan 5 tetes CuSO4.5H2O
– Ditambahkan 2 ml NaOH 0,1 M
BAB III
HASIL DAN PEMBAHASAN
1. HASIL
– Kelarutan Asam Amino dan Protein
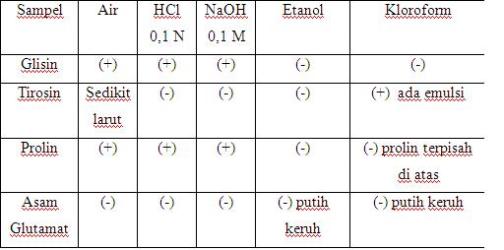
Keterangan : (+) larut
: (-) tidak larut
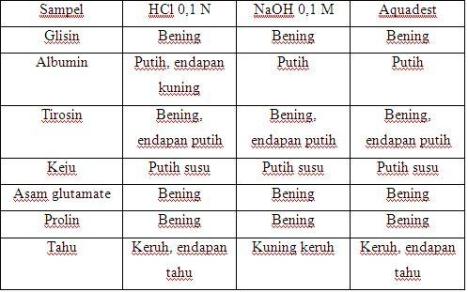
– Denaturasi Protein oleh Panas dan Ph
2. Pembahasan
Untuk asam amino glisin (H), pelarut yang cocok adalah air, HCl 0,1 N dan NaOH 0,1 M karena gugus R dari glisin adalah H jadi atom Hnya dapat berikatan dengan HCl dan NaOH. Untuk asam amino tirosin (HO-C6H4-CH2) pada air hanya larut sedikit, pada HCl 0,1 N, NaOH 0,1 M dan etanol tirosin tidak dapat larut sedangkan pada kloroform dapat larut dan terbentuk emulsi karena gugus R amino terlalu kompleks sehingga sukar larut dalam pelarut manapun. Prolin ((CH2)3) dapat larut pada air, HCl 0,1 N dan NaOH sedangkan pada kloroform prolin terdapat diatas, itu berarti berat jenis prolin lebih kecil daripada kloroform. Asam glutamate (HOOC-(CH2)2) tidak dapat larut pada semua pelarut karena strukturnya yang terlalu kompleks dan pada etanol dan kloroform membentuk kekeruhan.
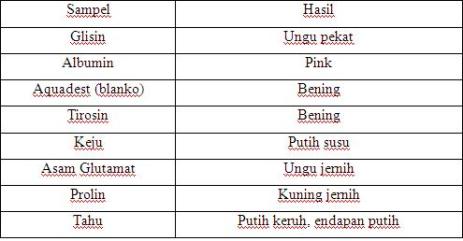
Ninhidrin merupakan reagen pengoksidasi kuat yang bereaksi dengan seluruh α asam amino. Dalam suasana asam yang lebih jelasnya pada PH 4 – 8 yang menghasilkan senyawa berwarna ungu. Ninhidrin ini zat yang bereaksinya adalah protein dengan triketohydrindene hidrat. Semua asam amino, atau peptida yang mengandung asam-α amino bebas akan bereaksi dengan ninhidrin membentuk senyawa kompleks berwarna biru-ungu. Namun, prolin dan hidroksiprolin menghasilkan senyawa berwarna kuning.
Adapun prinsip reaksinya akan dijelaskan seperti berikut ini.
Ninhydrin merupakan oksidator yang menyebabkan dekarboksilasi oksidatif dari α asam amino yang menghasilkan CO2, NH3, dan aldehid yang rantainya lebih pendek 1 C dari asam amino asalnya. Ninhydrin yang tereduksi akan bereaksi dengan NH3 sehingga membentuk senyawa kompleks berwarna biru atau ungu dengan absorpsi warna maksimum pada panjang gelombang 570 nm. Reaksi ini bereaksi positif hampir dengan semua jenis protein.
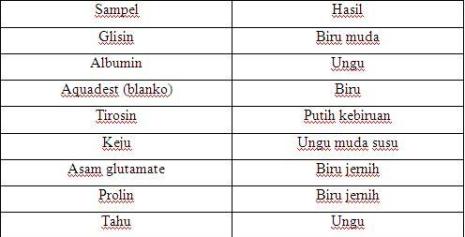
Denaturasi protein merupakan suatu proses dimana terjadi perubahan atau modifikasi terhadap konformasi protein, lebih tepatnya terjadi pada struktur tersier maupun kuartener dari protein. Buiret adalah senyawa dengan dua ikatan peptida yang terbentuk pada pemanasan dua mulekul urea. Ion Cu2+ dari preaksi Biuret dalam suasana basa akan berekasi dengan polipeptida atau ikatan-ikatn peptida yang menyusun protein membentuk senyawa kompleks berwarna ungu atau violet. Reaksi ini positif terhadap dua buah ikatan peptida atau lebih, tetapi negatif untuk asam amino bebas atau dipeptida.
Tujuan dari pengujian biuret ini adalah untuk mengetahui adanya ikatan peptide. Adapun prosedurnya yaitu pertama – tama, protein bereaksi dengan NaOH dan CuSO4. Fungsi dari NaOH itu adalah mencegah endapan Cu (OH)2, dan memecah ikatan protein menjadi urea, sebagai katalisator. Adapun fungsi CuSO4 adalah sebagai pendonor Cu2+ . seperti yang telah diuraikan sebelumnya reaksi positif ditandai dengan terjadinya warna ungu karena adanya kompleks yang terjadi antara ikatan peptida dengan O dari air. Reaksi ini disebut reaksi biuret karena positif terhadap kondensasi 2 molekul urea. Lebih jelasnya dapat dilihat reaksi berikut ini.
2CO(NH2)2 CONH2 – NH –CONH2 (biuret) + NH3
CuSO4+ 2H2O Cu(OH)2 + H2SO4
Cu(OH)2 + NH3 warna ungu
Reaksi juga positif terhadap senyawa organik yang mempuyai gugus CO(NH2), SC(NH2), NHC(NH2), H2C(NH2)
Ikatan peptide panjang ungu
Ikatan peptide pendek pink
BAB IV
SIMPULAN
Dari praktikum “Asam Amino dan Protein” dapat disimpulkan bahwa:
Air bukan merupakan pelarut yang baik untuk asam glutamate karena pH asam glutamate lebih rendah dari air
HCl 0,1 N dan NaOH 0,1 M merupakan pelarut yang baik untuk asam amino glisin dan prolin karena glisin dan prolin mempunyai gugus H
Etanol bukan merupakan pelarut asam amino yang baik
Kloroform merupakan pelarut yang baik tirosin tetapi menimbulkan emulsi (polar dan non polar)
Ninhidrin merupakan reagen pengoksidasi yang sangat kuat, akan bereaksi dengan semua asam amino pada pH antara 4 sampai 8 membentuk senyawa berwarna ungu
Reaksi ninhidrin juga positif untuk amina primer atau ammonia tanpa adanya CO2 yang dibebaskan
Asam amino, prolin dan hidroksi prolin dengan ninhidrin memberikan warna kuning
Rekasi ninhidrin sangat sensitif dan sesuai untuk penentuan asam amino secara kuantititatif
Denaturasi protein menyebabkan perubahan pada struktur tersier maupun kuartener karena panan dan pH yang ditandai dengan kekeruhan atau warna putih pada sampel setelah ditambah asam atau basa dan setelah dipanaskan pada waterbath
Kupri sulfat dalam suasana basa bereaksi dengan senyawa yang mengandung 2 atau lebih ikatan peptide, akan menghasilkan senyawa kompleks yang berwarna ungu
Intensitas warna yang dihasilkan pada reaksi biuret tergantung pada banyaknya ikatan peptide yang terdapat pada protein
Semakin banyak ikatan peptide makan intensitas warna yang dihasilkan akan semakin tua contoh pada produk yang mengandung protein akan berbeda dengan asam amino yang menghasilkan warna biru muda atau biru
DAFTAR PUSTAKA
http://www.academia.edu/7493114/LAPORAN_ORGANIK_ASAM_AMINO_DAN_PROTEIN/
http://ujibiuret.blogspot.com/
http://bisakimia.com/2012/11/11/denaturasi-protein/